第一,本事项在网上政务大厅的正式名称和代码是“第一类医疗器械生产备案”,“5714”。适用范围是“适用于本区第一类医疗器械生产备案及其备案事项变更的申请与办理。”
第二,办理本事项需要具备以下条件
(一)办理医疗器械生产备案的是境内生产企业;
(二)从事第一类医疗器械生产的企业应当具备以下条件:
1、有与生产的医疗器械相适应的生产场地、环境条件、生产设备以及专业技术人员;
2、有对生产的医疗器械进行质量检验的机构或者专职检验人员以及检验设备;
3、有保证医疗器械质量的管理制度;
4、有与生产的医疗器械相适应的售后服务能力;
5、产品研制、生产工艺文件规定的要求。
详见附录《医疗器械生产质量管理规范》。
(三)取得受托生产医疗器械相应范围的生产许可或者办理第一类医疗器械生产备案的境内生产企业可以接受委托生产中的受托生产产品备案;
(四)医疗器械生产备案的形式是申请生产医疗器械的企业,向食品药品监督管理部门递交规定资料,并承诺资料的完整性和真实性,提供资料存档备查。
首次开办第一类医疗器械生产企业的,除需要满足上述条件之外还需要备案企业持有自己的所生产医疗器械备案凭证。
第三,办理本事项您需要准备以下材料
(一)形式标准
1. 备案材料应完整、清晰;
2. 网上备案信息应与纸质备案材料一致;
3. 企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等应按照营业执照内容填写;
4. 企业名称、法定代表人、企业负责人、住所地址应与医疗器械生产许可证内容一致(第二、三类医疗器械生产企业适用);
5. 对照国家及本市食品药品监督管理部门政府外网的专栏信息进行审查,备案材料中的相关人员应未被纳入市食品药品监管局重点监管名单或国家药品安全“黑名单”;
6. 生产范围应按照国家食品药品监督管理总局颁布的医疗器械分类目录中规定的管理类别、分类目录类代号和类代号名称填写;
7. 备案材料应附有目录,排列有序,装订整齐,逐页编码,页号用阿拉伯数字编写在页面底部,纸张无破损、规格统一(一般用A4纸);
8. 复印件应注明“与原件核对无误”,并加盖公章;
9. 卷内文字应使用蓝黑、碳素墨水钢笔或者签字笔。
第一类医疗器械生产备案凭证申请材料
1.第一类医疗器械生产备案表
2.所生产产品的医疗器械备案凭证
3.经备案的产品技术要求
4.营业执照和组织机构代码证
5.法定代表人、企业负责人身份证明
6.生产、质量和技术负责人的身份、学历职称证明
7.生产管理、质量检验岗位从业人员、学历职称一览表
8.生产场地的证明文件(有特殊生产环境要求的,还应提交设施、环境的证明文件)
9.主要生产设备和检验设备目录
10、质量手册和程序文件
11、工艺流程图
12、经办人授权证明
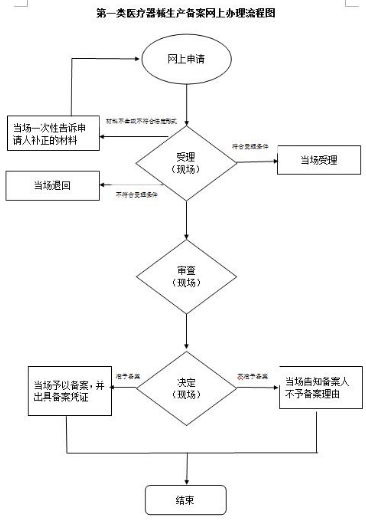
第一类医疗器械生产备案流程:
网上办理流程